引言
在探索大脑奥秘的征途中,胞外电信号扮演着至关重要的角色。本文专注于局部场电位(LFP)和尖峰(spike)的分析,不涉及其他信号类型与胞外信号的复合分析。胞外电位的处理方法繁多,本文将讨论几种最基础、最具代表性的分析方法,旨在帮助研究者从复杂的脑电数据中提炼出有用的神经元运行机制。通过对电流源密度(CSD)的计算,我们能够定量描述不同脑区神经元活动的剧烈程度;而通过优化的放电频率(FR)的计算方法,我们能够更准确地捕捉到单个神经元的放电规律。此外,本文还将比较LFP和spike包含的信息量。在文章末尾,我们会对神经元活动的干预方法做个简单的引伸。
01
LFP分析:电流源密度
在前一篇文章中《胞外电位的产生和传播》,我们已经讨论了几乎所有能影响胞外电位的因素。现在回到那个更重要的问题:如何从记录到的胞外电信号中解析出大脑活动的规律?
随着人类工程能力的进步,我们可以在微米尺度上集成数千个电极触点,该尺度已经接近甚至小于神经元的胞体。这意味着,借助这些电生理工具,神经科学家们能以前所未有的时空分辨率来监测神经元的活动。为了定量描述脑内各区域神经元活动的剧烈程度,科学家们创造出了电流源密度的概念(Current source density,CSD),其计算公式为:Im=−σ∇2Φ。等式左边的Im为电流源密度;右边的σ为脑组织中的电导率(将其看作一常数);∇2Φ表示电位在空间上的二阶导数,即电位的变化率。
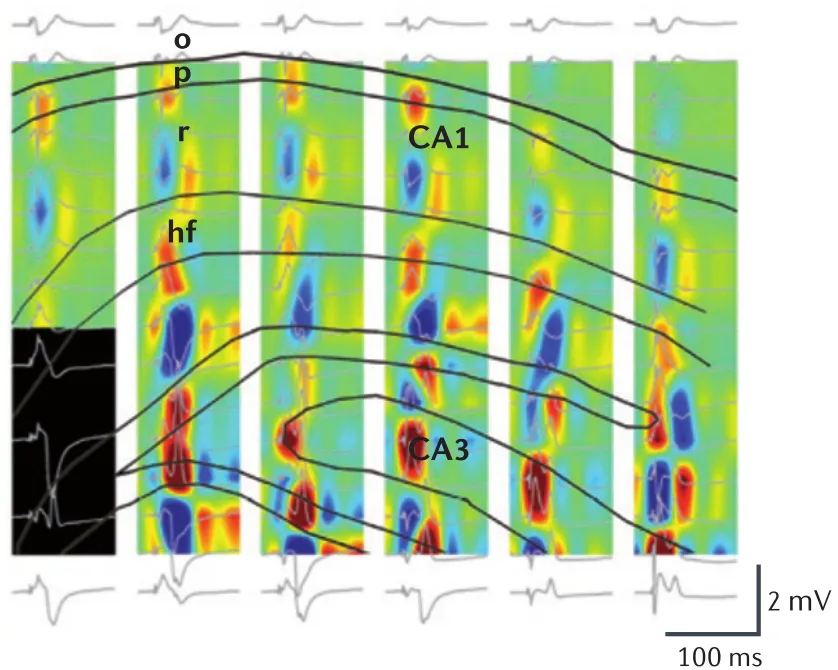
图 1 大鼠海马脑区场电位CSD[1]黑色实线勾勒出海马各亚区的结构,图中的6列图为6纵向排布的电极记录到的胞外电信号;16行场电位波形(灰色)来自单根电极上的16个触点。
借助CSD分析,我们可以绘制出神经元胞外电位的全景图。如图1所示,将触点分布在6个shank上的96通道电极植入大鼠的海马脑区,在大鼠自由移动的过程中,海马区接收到上游内嗅区(entorhinal)的投射后,其胞外电位会呈现规律性的源(source)-汇(sink)交替变化。波形朝上的场电位表示该处有大量正电荷流出,对应红色区域(源);相反,朝下的场电位波形表示该处的正电荷正流入胞内,对应蓝色区域(汇)。由图中红蓝区域的位置关系,我们可以定量描绘出海马在接受一次内嗅区输入后的活动模式,进而找到该过程和某种生理功能或动物行为表现间的关系。
02
Spike分析:firing rateSpike的放电频率(Firing rate,FR)能最直观地展现单个神经元的放电模式,因此,准确地计算FR尤为重要。处理像Spikes这样的离散信号,无外乎两种思路:让它继续“离散着”和让它“连续起来”[3]。
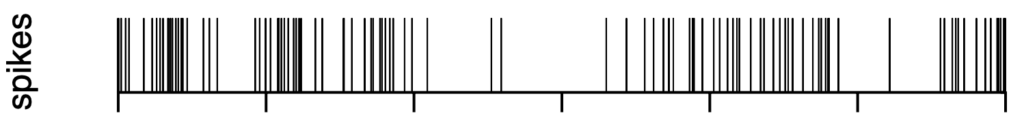
图 3 spikes信号我们可以将一段时间等分成许多短暂的时间窗口(bin),然后计数bin中的放电数目,再用放电数目除以bin的宽度。这些时间窗口可以首尾相连,也可以有所交叠,后者往往能提供更高的时间分辨率。
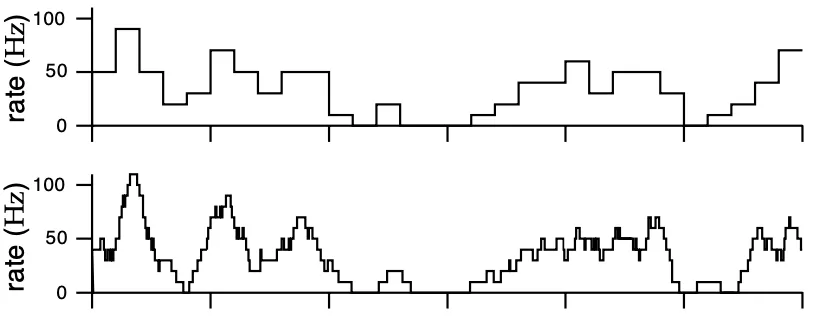
图 4 单神经元放电频率直方图时间窗口首尾相连(上);时间窗口首尾交叠(下)。横坐标为时间。
然而,在上述FR的计算方法中,存在一些问题:
- 量化效应:由于脉冲数量是整数,所以计算出的放电率会是某些特定值的倍数,例如 1/Δt、2/Δt 等。这会导致放电率是离散的,而不是连续的。
- 分辨率问题:如果Δt过大,时间分辨率不足,无法捕捉到快速变化的放电率;如果Δt过小,每个bin中的脉冲数量可能过少,计算出来的FR没有意义。
为了解决以上问题,我们可以使用可变bin宽的方法。具体步骤如下:
- 固定脉冲数量:首先决定每个bin中包含的脉冲数量(例如每个bin中包含k个脉冲)。
- 调整bin宽度:根据实际脉冲的时间分布,调整每个bin的宽度,使得每个bin中恰好包含k个脉冲。
示例
假设我们希望每个bin中包含3个脉冲:如果在某个时间段内脉冲密集,bin的宽度会较小;如果在某个时间段内脉冲稀疏,bin的宽度则可以相应增大。对于每个bin,放电率计算如下:
ri=k/Δti
其中,Δti 是第 i 个bin的宽度,k是每个bin中包含的脉冲数量。这种方法允许我们根据脉冲密度动态调整时间分辨率:在脉冲密集的区域,时间分辨率高;在脉冲稀疏的区域,时间分辨率低。由此保证每个bin的放电率估计都是基于足够的脉冲数量,从而提高估计的稳定性。
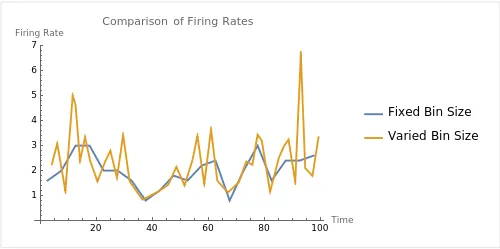
图 5 固定时间窗口(蓝)和可变时间窗口(黄)法计算得到的神经元放电频率
现在,让我们换个思路——将离散的信号连续化。如下图所示,借助2种不同的窗口函数(window function),经由卷积计算,我们可以将离散的神经信号转换成连续的放电频率曲线。
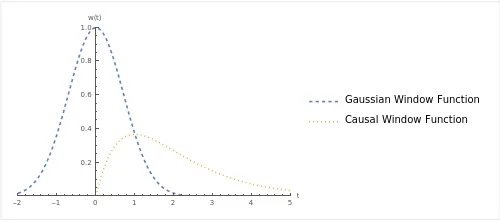
图 6 用于平滑FR的窗口函数
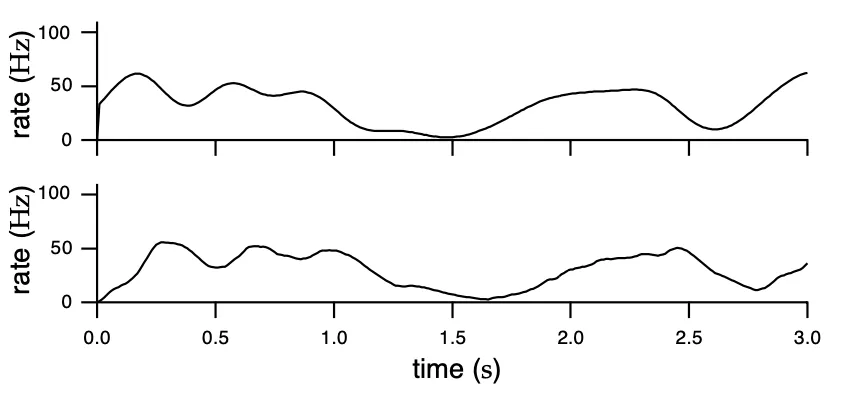
图 7 放电频率平滑化经过高斯窗口函数(上)和因果窗口函数(下)平滑处理后的神经元放电频率值得一提的是,在使用因果窗口函数时,我们认为,发生在当前时刻之后的放电不应该被用来描述当前时刻的放电频率,因为有的spike都只和前面的放电有关,即只有过去能决定现在,而未来不能影响现在。
03
回到信息论:LFP和spike的信息量神经信号解码准确率由三个因素共同决定:信号中包含的信息量、记录到的信号质量以及解码方法。而后两个因素又受限于第一个因素。换句话说,spike 和 LFP 电位包含的信息量决定了解码结果的上下限。因此,我们有必要回到信息论本身,重新审视胞外电信号。
让我们假设手上有一段用侵入式电极记录到的、小鼠皮层区域的、10min的、单通道胞外电位原始数据。我们先通过滤波的方式区分出原始数据中的LFP(通常为0-300Hz)和spike信号(通常为300-4000Hz),再进行如下计算。
1. 数据预处理a. 信号分段
将每个通道上记录到的1秒钟信号分为若干小时间窗口(例如,窗口长度10毫秒)。这样,1秒钟的信号可以被分割成100小段。b. Spike信号处理
在每个时间窗口内,计数记录到的spike的次数。通常,这个计数可以直接转换为该时间窗口内的神经元放电率。c. LFP信号处理
将LFP信号在每个窗口内进行量化处理。可以选择将LFP信号的振幅分为几个等级(例如,根据信号的分布将振幅分为高、中、低三个等级)。
2. 概率分布计算a. 计算概率
对于每种spike的计数和每种LFP的振幅等级,计算其在所有窗口中出现的频率。这些频率将被用作概率的估计。
3. 信息熵计算a. Spike信息熵
使用公式H(S)=−∑p(si)logp(si)计算,其中 si是特定窗口内spike计数的结果,p(si)是该结果出现的概率。b. LFP信息熵
同样使用信息熵公式H(L)=−∑p(lj)logp(lj),其中 lj是特定窗口内LFP的振幅等级,p(lj)是这个等级出现的概率。
4. 计算信息熵假设我们有以下的频率数据:· Spike计数结果:0次 (50个窗口),1次 (30个窗口),2次 (20个窗口)· LFP等级:低 (40个窗口),中 (40个窗口),高 (20个窗口)a. 计算概率· Spikes:p(0次) = 0.5, p(1次) = 0.3, p(2次) = 0.2· LFPs:p(低) = 0.4, p(中) = 0.4, p(高) = 0.2b. 信息熵计算· Spikes:H(S)=−(0.5log0.5+0.3log0.3+0.2log0.2) =1.485 bits· LFPs:H(L)=−(0.4log0.4+0.4log0.4+0.2log0.2) =1.522 bits
如此看来,LFP包含着比spike更多的信息量。
然而,在解决神经生物学问题时,对两种信号的应用并非泾渭分明。LFP通常反映了区域内神经组织的平均活动,时间分辨率较低(通常在几十到几百毫秒)。这意味着LFP不能精确地描绘出单个神经元快速的放电事件,而spike 信号时间分辨率更高,能精确捕捉单个神经元的放电瞬间。假设我们正在进行一个解码任务,目标是确定大鼠能否能感觉到一种特定的触觉刺激。这种触觉刺激非常短暂,只持续几毫秒。利用电极记录大鼠在任务过程中的皮层LFP和spike信号。LFP只能反应出特定脑区在刺激前后的总体活动水平变化,而不足以指示刺激发生的确切时刻。相反,spike信号能够明确地展示刺激发生时单个神经元的反应模式,这使得研究者们可以准确地判定刺激发生的时间点,甚至分析神经元放电模式与刺激类型间的关系。
04
LFP和spike的搭配使用
更进一步,LFP和spike间的关系往往能提供更多的信息。
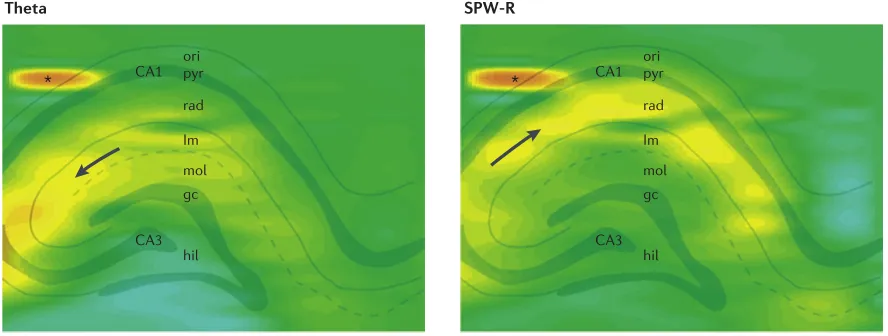
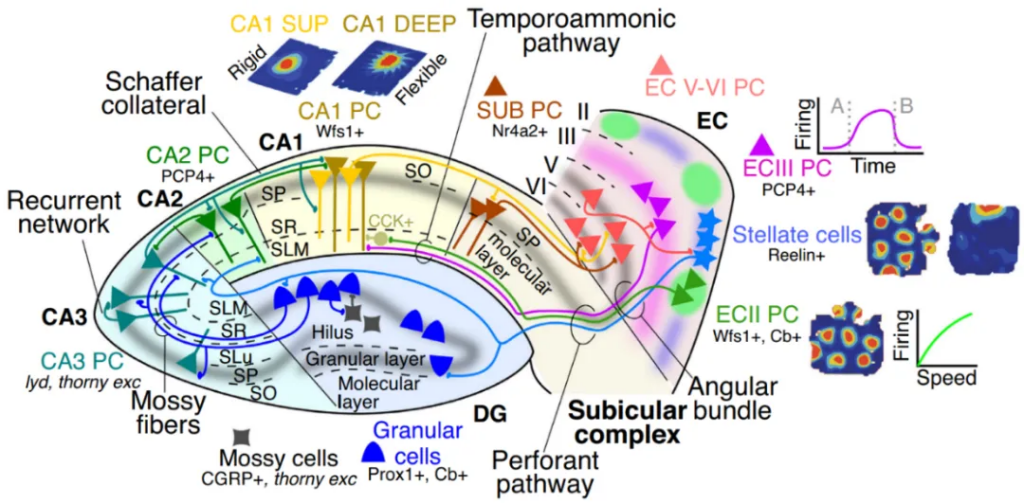
如上图所示,将8根间距为300微米的侵入式电极(每根电极上有32个记录位点)植入大鼠海马脑区,我们能监测到动物清醒活动和睡眠期间精细的脑电活动。左右两图中左上角的星号位置表明在CA1的始层(stratum oriens)记录到了高频的中间神经元放电(spikes),在同一时刻(左图),我们观察到在CA1的多孔-分子层(stratum lacunosum-moleculare)和齿状回的分子层(dentate molecular layer)出现了较大的负向波(左图中黑色箭头)。参照图2中的投射关系,图中spike和LFP的空间分布表明此刻海马胞间层(stratum lacunosum-moleculare,lm;由箭头指示)和齿状回分子层(molecular layer,mol)接受到了大量来自内嗅皮层(entorhinal cortex)的传入信号,这类信号极有可能与位置信息的表征有关(该时期可以到LFP标性的theta节律(4-12Hz));再来看右图,同样是CA1中间神经元爆发强烈的spike,可以观察到LFP的场电位正由CA3向CA1的辐射层(stratum radiatum,rad;由箭头指示)扩布。这提示我们海马可能正在进行模式分离(pattern seperation)和模式完成(pattern completion)的工作。
【扩展阅读:模式分离通过将相似输入转化为不同的表征来减少干扰,模式完成则利用CA3的回路连接从部分线索重建完整记忆。CA1区整合CA3的输入,并将其传递给下游脑区。】
由此,我们借助spike和LFP的空间分布,初步建立起了结构和功能间的关系。另一个常见的分析方法则是观察spike与LFP波形在时间上的相对关系。
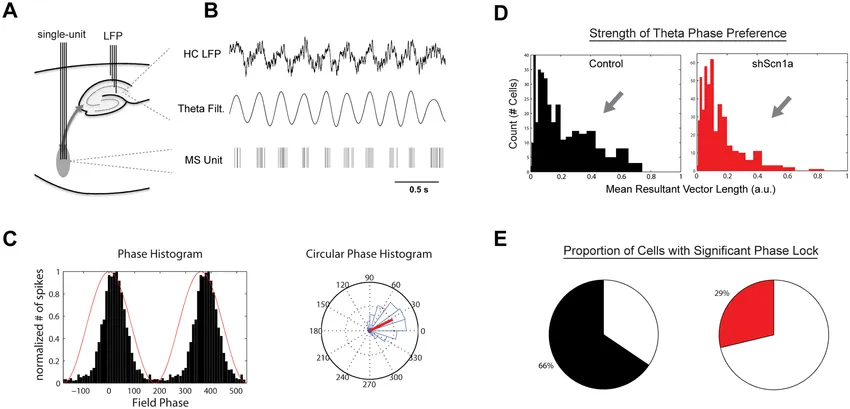
如上图所示,将侵入式电极插入MSDB和海马脑区分别记录spike和LFP信号(图9AB),可以发现,MSDB区域神经元的放电总是与海马theta节律的波峰同时出现(图9C),我们将该种现象称作锁相(phase-lock)。锁相的出现暗示二者间可能存在因果关系,而在介隔区域敲除SCN1A基因(介导Nav1.1通道蛋白的表达)后,锁相现象减弱了(图9DE),这种减弱对应着动物认知能力的衰减。至此,我们可以得出结论:Nav1.1通道缺陷通过破坏介隔-海马网络中的正常锁相关系,进而影响海马θ节律,最终导致空间工作记忆功能障碍,因此,Nav1.1通道的正常运行对于认知功能至关重要。【扩展阅读:介隔-布罗卡带复合体(MSDB)与海马是大脑边缘系统的关键组分,在θ节律的生成和调节中二者扮演了重要的角色,这对于理解和治疗癫痫至关重要。MSDB通过胆碱能、GABA能和谷氨酸能神经元投射调控海马脑区的神经元,这些投射是维持海马θ节律的必要条件,而θ节律又与学习、记忆和导航等认知功能密切相关。MSDB还可以通过影响兴奋性和抑制性输入的平衡来调节海马的状态,从而促进或抑制海马的癫痫活动。MSDB-海马通路的功能障碍可能导致兴奋与抑制之间的失衡,这是癫痫的基本病理特征之一。此外,对MSDB中神经递质系统的具体作用的了解能为药物干预提供新的靶点。例如,增强MSDB的GABA能神经元的抑制功能,理论上就可以抑制海马的过度兴奋。MSDB与海马之间的放电模式或连接性变化也有可能成为癫痫发作开始或评估癫痫缓解效果的生物标记物[5]。】
05
从被动记录到主动干预前文中的所有分析都来自被动地记录胞外电位,而要进一步探究结构和功能的关系,我们就需要主动改变结构或关系本身,同时观察脑功能在各个尺度上的变化。
只要能改变脑组织中离子的正常移动方式,就能改变神经元的活动模式(声,光,热,电,磁和力中的任何一种都能被用来干预离子的移动)。不仅如此,依据神经元的放电特性,干预工具需具备极高的时间和空间分辨率,现今的微观神经调控技术中,最好用的是光。
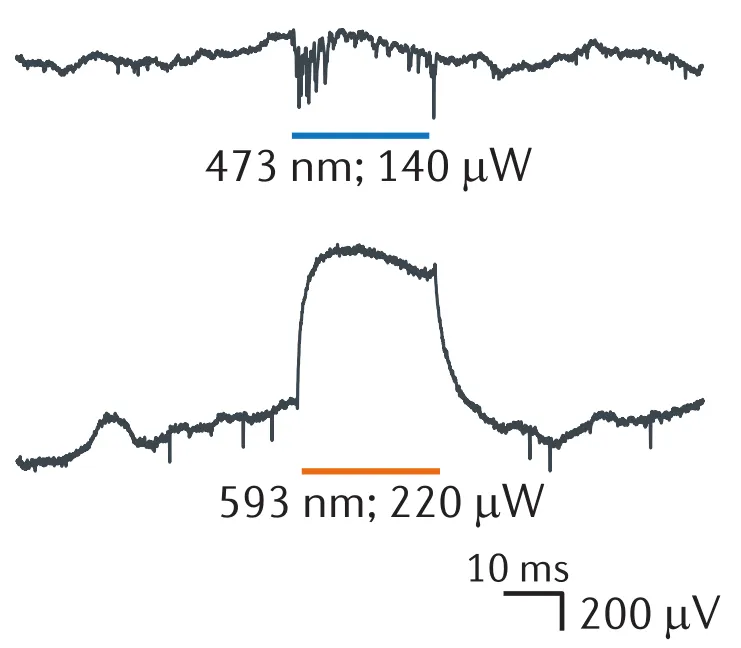
图 10 光激活(上)和抑制(下)期间海马CA1区胞外电位变化[1]如上图所示,科学家们通过基因改造,使神经元能够响应不同波长的光。这使得我们可以在毫秒和微伏的尺度上增强或减弱神经元的电活动,从而找到神经元的活动模式和脑功能间的因果关系。
结语
本文介绍了胞外电位的几种基本分析方法,揭示了局部场电位(LFP)和尖峰(spike)在神经元活动中的重要作用。首先,电流源密度(CSD)计算能够量化脑内群体神经元活动的空间分布。其次,优化的放电频率(FR)计算方法能够更好地捕捉到单个神经元的活动模式。此外,LFP和spike的信息量对比展示了它们在神经生物学研究中的互补性。最后,主动干预神经元活动的方法(如光遗传技术),进一步深化了我们对脑功能的理解。
参考资料
[1] Buzsáki, G., Anastassiou, C. A., & Koch, C. (2012). The origin of extracellular fields and currents—EEG, ECoG, LFP and spikes. Nature reviews neuroscience, 13(6), 407-420.
[2] Valero, M., & de la Prida, L. M. (2018). The hippocampus in depth: a sublayer-specific perspective of entorhinal–hippocampal function. Current opinion in neurobiology, 52, 107-114.
[3] Dayan, P., & Abbott, L. F. (2005). Theoretical neuroscience: computational and mathematical modeling of neural systems. MIT press.
[4] Bender, A. C., Luikart, B. W., & Lenck-Santini, P. P. (2016). Cognitive deficits associated with Nav1.1 alterations: involvement of neuronal firing dynamics and oscillations. PLoS one, 11(3), e0151538.
[5] Nuñez, A., & Buño, W. (2021). The theta rhythm of the hippocampus: from neuronal and circuit mechanisms to behavior. Frontiers in cellular neuroscience, 15, 649262.

发表回复